








《化学电源基本概念PPT课件下载(共34页)》是由用户上传到老师板报网,本为文库资料,大小为532.5 KB,总共有34页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 34页
- 532.5 KB
- VIP模板
- ppt
- 数字产品不支持退货
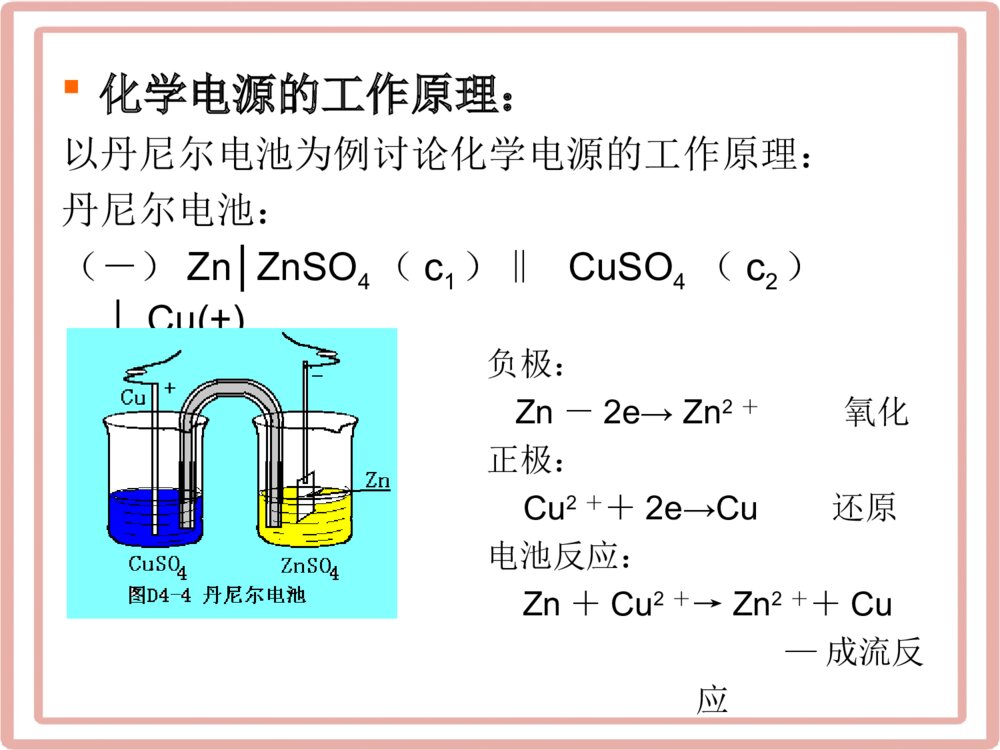
第一节化学电源的基本概念主要内容:•化学电源的组成和工作原理•化学电源的分类•化学电源的主要性能•电极的组成、结构和成型方法本章重点:•化学电源的组成和工作原理:构成电池的必要条件;化学电源的基本组成部分及其作用。•化学电源的主要性能:开路电压和电动势的意义及区别;内阻及其对电池性能的影响;工作电压及放电曲线的意义;容量、比容量、放电时率与放电倍率,利用率及其影响因素;能量,高比能量电池的条件;功率及其影响因素;自放电及其影响因素。一、化学电源的组成和工作原理构成电池的必要条件:•化学反应中的两个过程必须分隔在两个区域进行。(区别于一般的化学反应)•物质在发生氧化还原反应时,电子必须经过外电路。(区别于腐蚀电池)化学电源的基本组成部分及其作用:•电极•电解质•隔膜•外壳化学电源的工作原理:以丹尼尔电池为例讨论化学电源的工作原理:丹尼尔电池:(-)Zn│ZnSO4(c1)‖CuSO4(c2)│Cu(+)负极:Zn-2e→Zn2+氧化正极:Cu2++2e→Cu还原电池反应:Zn+Cu2+→Zn2++Cu—成流反应二、化学电源的分类按工作性质分:•原电池,又称一次电池•蓄电池,又称二次电池•储备电池,又称激活式电池•燃料电池,又称连续电池•电化学电容器:超大容量或者超级电容器,介于传统电容器和电池之间的新型电源;分为双电层电容器和赝电容器按电解质的性质分:•电解质为碱性水溶液—碱性电池•电解质为中性水溶液—中性电池•电解质为酸性水溶液—酸性电池•电解质为有机电解质溶液—有机电解质电池•电解质为固体电解质—固体电解质电池按正负极活性物质的材料分:•Zn-MnO2系列电池。•Zn-AgO系列电池•Cd-NiOOH电池•铅酸电池•氢镍电池•锂离子电池等等活性物质的保存方式分:•活性物质保存在电极上通常的一次、二次电池•活性物质从外边连续供给电极燃料电池三、化学电源的主要性能电池的开路电压与电动势:•电动势E:电池两极断路时,处于热力学平衡状态下,两极平衡电位之差。开路电压V开:电池断路时,两极的稳定电位之差。电池的电动势的大小是通过电池热力学原理理论计算获得,不能实验测定。即:E平平aAnecCbBnedD正极:负极:lncdcdabABRTnFaaEaa平平GE=-nFE平平000正负正负(G)(G)G=-nFnF由此可以明确地看出,若正极的电位越正,负极的电位越负,电池的电动势也就越高。从元素的标准电位序来看,在元素周期表左上边的元素(IA,IIA族)具有较负的电位,右上边的元素(VIA,VIIA族)具有较正的电位。由这些元素组成的电池可以得到较高的电动势。其中以Li的电位为最负:平=-3.045VLieLi(在酸性介质中)氟的电位为最正:平=2.87V若做成锂氟电池,其电动势可达5.91V。这是化学电源中电动势最高的数值。应当注意的是,在选择电极活性物质时,不能只看平衡电位数值的高低,还要看(1)它在介质中的稳定性(2)材料来源(3)电化当量等多方面的因素。例如Li-F2,若组成电池,它具有很高的电动势,但由于Li只适用与非水溶剂电解质,F2是活性的气体,不易储存和和控制,因而由单质Li与F2组成电池也是不切合实际的。FeF222LiFFLi222电池的内阻:•电流通过电池内部时受到的阻力,也叫全内阻。•包括两部分:电池的欧姆内阻电极的极化所相当的内阻,也叫极化内阻电池的工作电压及放电曲线:•工作电压电池工作时两端的电压•放电制度人为规定的放电条件称为放电制度(放电电流、放电温度、放电的终止电压、放电方式)•放电曲线用绘图的方式表示出电压随时间的变化曲线根据电池的放电曲线,通常可以确定电池的放电性能和电池的容量。1.通常电池的放电曲线越平坦、稳定、电池的性能就越好。2.电池的容量大小。电池的容量和比容量:•电池的容量电池在一定的放电制度下,所放出的电量C,可以用安时(Ah)表示。Ah表示1安培(A)电流放电1小时(h)。1.理论容量:理论容量是根据活性物质的重量按法拉第定律计算出的电量。理论容量的计算方法(举例说明)例如:设某电池中的负极为Zn,其重量为13.5克,求锌电极的理论容量?电极反应:22ZneZn另外由法拉第定律知道,1克当量的活性物质可产生96500库仑的电量(96500/3600=26.8Ah),也就是该有32.69克的Zn,就可以产生26.8Ah的电量,所以现在有13.5克的锌,理论上所能产生的电量应为:Q理=13.5/32.69×26.8=11.1Ah另外由于32.69克锌可产生26.8Ah的电量,故我们又可以得到:从反应式知锌的反应电子数为2,故1克当量的Zn应为65.38÷2=32.69克32.69克/26.8AH=1.22克/AH即理论上得到1Ah的电量,就需要消耗1.22克的锌或消耗1克锌就可得到0.82Ah的电量。或26.8Ah/32.69克=0.82Ah/克通常把输出1Ah的电量,理论所需要的活性物质的量称为该物质的电化当量。有了电化当量,对理论电量的计算更为方便了。如上例:Q理=13.5/1.22=11.1Ah2.实际容量:实际容量指在一定的放电制下(放电方式,一定的电流密度和终止电压等),电池所能给出的电量。实际容量的计算:(1)若是恒电流放电(2)恒电阻放电由于恒电阻放电时,I是不断变化的,故QR要通过积分的方法计算:IQ=It(AH)00011tttRVQIdtdtVdtVtRRR平3.额定容量:额定容量是指在一定的放电制度下,电池应该给出的最低限度的容量。也就是设计指标。电池的容量是电池的一个很重要的性能指标。一个电池的实际容量往往小于其理论容量,这主要是由于活性物质的利用率低,不能达到100%。对活性物质的利用率可用下式计算:活性物质利用率(%)=M/g×100%M-放电时按法拉第定律计算应消耗的物质的重量g-电池中实际存在的活性物质的重量例如:13.5克锌理论上可放出11.1AH的电量,若实际上用了20克,则:13.5/20=67.5%•影响容量的因素:1.活性物质的量:2.活性物质的利用率活性物质的活性电池和电极的结构电解液的量、浓度、质量制造工艺放电制度放电时率与放电倍率:•放电时率以一定放电电流放完额定容量所需要的小时数放电倍率:在规定时间内放完全部额定容量所需的电流值。例如:若电池的额定容量为10Ah,以2A放电,则:t放电时率=10Ah/2A=5h例如:若电池的额定容量为10Ah,以5H放电,则:t放电倍率=10Ah/5h=2A如是在1倍率(或叫1C)放电,是指用1h放完额定容量,所需电流为10A。如用2h放完电,则叫以0.5C放电,放电电流为10A·h/2h=5A能量和比能量:•能量电池在一定的放电制度下,对外做功所输出的能量。通常用瓦·时(Wh)表示•(1)理论能量从热力学上看,电池的理论能量等于可逆过程电池所能做的最大有用功:()WGnFEQEWH理电(2)电池的实际能量:电池在一定的放电条件下实际放出的能量。2.恒电阻放电时1.恒电位放电时0tIWIVdtTVt平22001ttIVWIVdtdtVtRR平(3)比能量:单位体积或单位重量的电池所输出的能量。1.体积比能量:单位体积电池输出的能量(瓦·时/L)2.重量比容量:单位重量电池所能输出的能量(瓦·时/Kg)a.理论重量比能量又可分为:b.实际重量比能量下面以铅酸电池为例说明理论比能量的计算:电池的总反应:参加反应的总物质:该反应能产生两个法拉第的电量,如果642.6克物质都能全部反应,则就能产生2×26.8=53.6Ah的电量。另查表可知:22442222PbPbOHSOPbSOHOM=207.2(Pb)+239.2(PbO2)+2×98.08(H2SO4)=642.6克(2/4)1.685PbOPbSOV正(4/)0.355PbSOPbV负所以:2.04EV正负故:642.6克反应物在理论上所能产生的电能为:设比能量为X,则642.6:109.3=1000:XW理=53.6×2.04=Q理·E=109.3WhX=170.2Wh/Kg对铅酸电池来说,由于H2SO4参加了反应,故其电动势与H2SO4的浓度有关。若取d=1.25的硫酸,换成活度V=2.104V。表1-1给出了一些电池的理论比能量和实际比能量。见下表:得到一些电池的实际比能量与理论比能量电池电池反应电动势(V)理论比能量(Wh/Kg)实际比能量(Wh/Kg)铅酸2.104175.510~50Cd–Ni1.326(E0)214.315~40Fe–Ni1.399(E0)272.410~25Zn–Ag1.8521.59V平=1.721487.560~160Zn-Mn1.623(开)251.310~50Zn–空气1.646(E-)1350100~25022442222PbPbOHSOPbSOHO222222()()CdNiOOHHONiOHCdOH222222()()FeNiOOHHONiOHFeOH22AgOZnAgOZnO第一段:22AgOZnAgZnO第二段:222AgOZnAgZnO2243222()ZnMnONHClMnOOHZnNHCl122ZnOZnO电池的功率与比功率:功率在一定的放电制度下,单位时间内电池所输出的能量。比功率(W/Kg,W/L).单位时间电池的比能量。比功率是电池的重要性能之一。一个电池的比功率越大,表示它可以承受的放电电流越大,或者说其可以在高倍率下放电。比功率与比能量通常在I不是很大时,P随I增大而增大,但比能量下降理论上电池的功率可以用下式表示:P=IE比功率比能量Zn-AgOZn-MnO2Zn-HgO电池的自放电和贮存性能:•贮存性能贮存时所表现出的性能。电池的贮存分为干贮存(不带电液)和湿贮存(带电液).•自放电电池在贮存一段时间后,容量要发生自动降低的现象.对于蓄电池,又叫充电保持能力.•发生自放电的原因蓄电池的循环寿命和使用周期:•循环寿命(使用周期)在一定的放电条件下,当电池的容量降到某一规定值之前,电池耐受的充放电循环次数•影响电池循环寿命的因素不同的电池使用周期是不相同的,例如:一般说来,Fe-Ni,Cd-Ni电池的使用寿命可达数千次。铅蓄电池约300-500次,Zn-Ag电池约40-100次。另外,蓄电池的使用寿命与放电深度、沉度、充放电率等条件都有关。(放电深度是指电池放出的容量与额定容量的百分比)。四、电极的组成、结构和成型方法电极的组成:•主要成分•导电组分•添加剂电极的结构:•整体电极•多孔电极1.三相多孔电极:电化学反应发生在固液气三相界面上2.两相多孔电极:电化学反应发生在固液两相界面上多孔电极最大的贡献实质上就是增大了电极的面积,从而降低了电极的极化,提高了活性物质的利用率。电极的成型方法:•涂膏式电极•压成式电极•烧结式电极•管(盒)式电极•电沉积式电极•粘结式电极•发泡式电极•纤维式电极



















